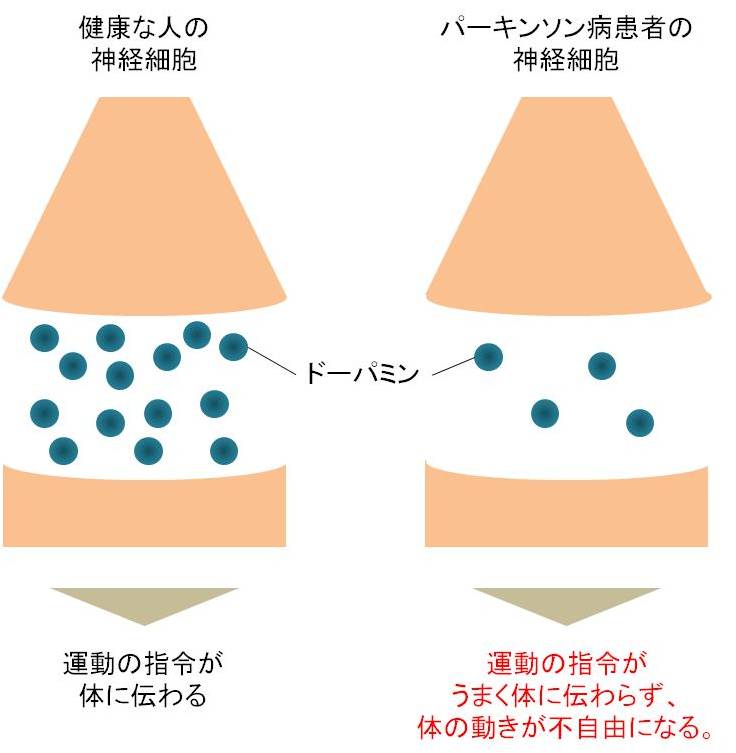
パーキンソン病は、手足のふるえ(振戦)、手足のこわばり(固縮)、動作が緩慢(寡動、無動)、転びやすくなる(姿勢反射障害)等の運動症状を引き起こすとともに、様々な全身症状・精神症状も合併します。症状がゆっくり進行するため、本人の自覚症状がないまま、症状が悪化することがあります。
この症状は、神経同士の連絡を司る物質の一つであるドーパミンを作る神経細胞の数が減少する事で起こります。その原因は不明な点が多く、いまだ十分に解明されていませんが、いくつかの遺伝子の異常や、環境との関わり、神経毒、酸化ストレス、ミトコンドリア機能障害等が仮説として挙げられています。
※2012年の慶應義塾大学と順天堂大学による共同研究で、酸化ストレス、ミトコンドリア機能障害については、パーキンソン病患者由来のiPS細胞から誘導した神経細胞において確認されました。
■ パーキンソンの主な治療法とは?
パーキンソン病に対する根本的な治療法はいまだ確立されておらず、以下に述べる運動症状や精神症状に対する対症療法がほとんどです。
|
治療法
|
概要
|
| 薬物療法 | ドーパミンの前駆物質であるレボドパ等を投与することで、パーキンソン病の原因であるドーパミン不足を補う事で症状を緩和します。 |
| リハビリテーション | 運動症状が現れるパーキンソン病では、様々な運動療法を実践することで、病状の安定や緩和、日常生活の質の向上を図ることが可能です。 |
| 手術療法 | 近年では、脳の一定の部位に電極を埋め込む脳深部刺激療法(Deep Brain Stimulation: DBS)と呼ばれる新しい治療法が開発されています。法薬物療法やリハビリテーションを補充する第3の治療方法として位置付けられています。 |
■ 再生医療/iPS細胞によるパーキンソンの治療
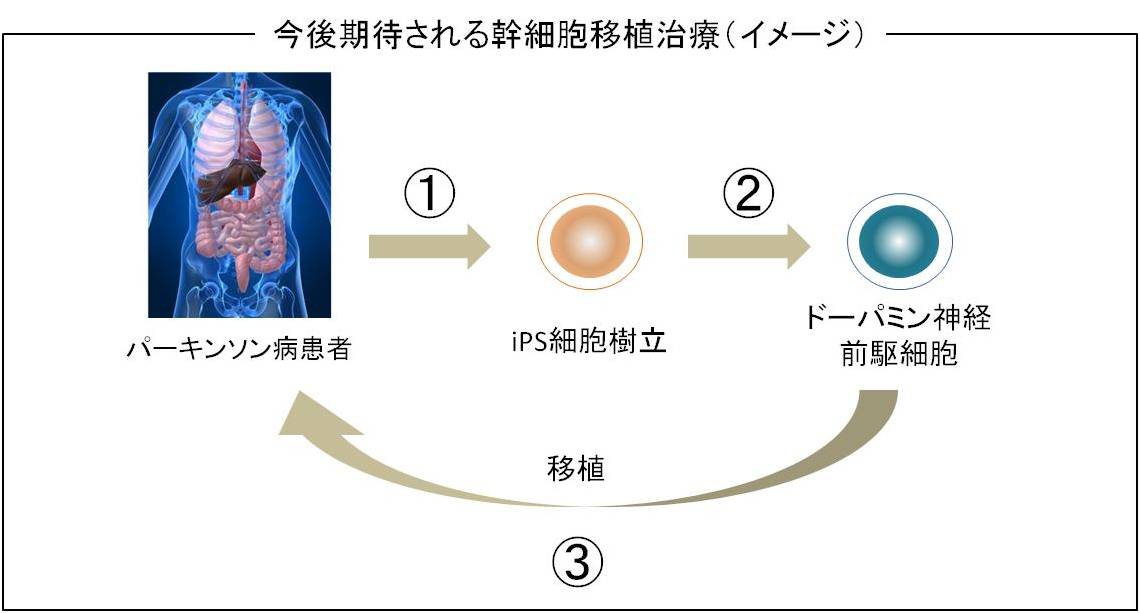
患者自身の皮膚などから作ったiPS細胞を、ドーパミンを分泌する細胞に分化させ、移植治療をするという方法が極めて有望な治療方法と考えられています。
2008年に、米国の研究グループが、マウスiPS細胞から作り出した神経細胞を使って、パーキンソン病のラットを治療することに成功しています。患者自身の皮膚などからiPS細胞を作れば、拒絶反応なしにこうした移植治療ができると期待されています。ただし、安全性に関してはまだ不明な点もあり、日本を始め世界中でより安全なiPS細胞の作製法が研究されています。
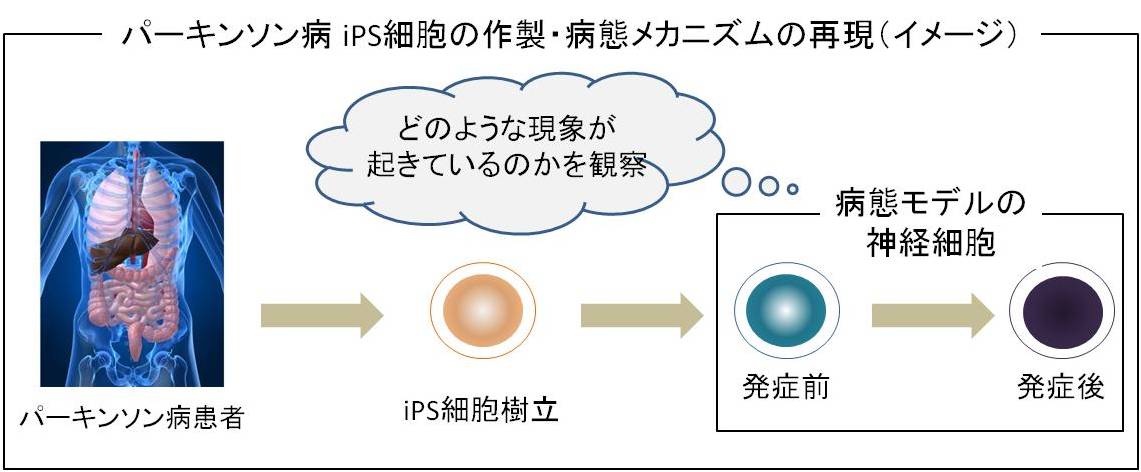
その後、2012年に、慶應義塾大学と順天堂大学が共同で、パーキンソン病患者からiPS細胞を作製し、パーキンソン病の病態メカニズムを再現することに成功しました。この研究成果は、病態解明と根本治療につながると期待されています。
■ パーキンソンに関する再生医療/iPS細胞の最新研究成果
| 再生医療適応症 | 作成する細胞 | 主要な研究機関 | 基本情報 | 研究の進捗状況 | 最新ニュース | ||||||
| パーキンソン病 | 神経細胞 | ・京都大学iPS研究所 ・慶應義塾大学 ・東北大学大学院医学系研究科 |
 |
||||||||
|
|||||||||||
<パーキンソン病に対する幹細胞移植治療の実現化>
京都大学iPS細胞研究所の高橋淳教授は、ヒトのES細胞(iPS細胞と同じく、様々な異なる細胞に分化し、増殖する能力を持つ発生初期の胚由来の細胞です。しかし、ヒトの起源となる受精卵を用いるため、倫理上の問題があるうえ、通常の臓器移植と同様の拒絶反応の問題があります。)から由来するドーパミン神経細胞をヒトと同じ霊長類であるカニクイザルに移植することによって、カニクイザルパーキンソン病の神経症状が改善されたことを確認しています。また分化誘導後に神経系細胞のみを選別して移植することによって腫瘍形成が抑えられることなどを明らかにしました。
また、ヒト iPS 細胞から誘導したドーパミン神経細胞も病態モデルとなるサルの脳内に生着することを確認しています。
これらの研究結果から、ヒトES細胞/iPS細胞を用いた、ヒトのパーキンソン病患者への移植治療が可能になることを示唆しています。詳しくはこちら。
また、東北大学大学院医学系研究科の出澤真理教授と理化学研究所分子イメージング科学研究センターの林拓也副チームリーダーらのグループは、骨髄間葉系幹細胞(骨髄中に存在する幹細胞)からドーパミン神経細胞の誘導に成功し、パーキンソン病モデルのサルの脳内への移植により、運動障害などが改善されるとともに、長期にわたり腫瘍形成や副作用が現れないことを明らかにしました。
本研究成果は、霊長類動物において独自の技術を用いて、上記の高橋教授らが研究しているES細胞やiPS細胞といった全能性を持つ幹細胞の移植研究とは異なり、成体幹細胞(ES細胞やiPS細胞とは異なり、全能性は持たないが、分化多能性を有しており、ES細胞とは異なり、成人の組織サンプルから得ることができ、ヒトの胚を破壊する必要がないため、研究と治療に使っても議論を招くことはない点で特色があります。)をドーパミン神経細胞の誘導し、自己の臓器内で移植・検証した世界で初めての成果であり、将来のパーキンソン病治療法として今後の臨床応用が期待されています。詳しくはこちら。
<パーキンソン病 iPS細胞の作製・病態メカニズムの再現>
慶應義塾大学医学部生理学教室の研究グループ(岡野栄之教授、今泉陽一研究員)と順天堂大学医学部脳神経内科(服部信孝教授)の共同研究グループが、特定遺伝子の変異が原因となり発症する家族性パーキンソン病患者からiPS細胞を作製し、それを神経細胞に分化・誘導することで、パーキンソン病患者さんの脳内で起きている現象を、同じ患者さん由来iPS細胞を用いて正確に再現しました。この研究結果は、パーキンソン病の病態解明や薬剤開発、早期診断法の開発につながるものと期待されています。
※上記の家族性に対して、明らかな遺伝性を示さないものを孤発性といい、パーキンソン病の大半は、この孤発性に分類されているといわれています。もっとも、後述する通り、孤発性パーキンソン病発症と関連したリスク遺伝子がいくつか発見され始めています。
具体的には以下の通りです。
まず、このiPS細胞では、酸化ストレスが増強され、ミトコンドリアに機能異常が生じている事が確認され、パーキンソン病においてドーパミンを作る神経細胞の数が減少する原因の一端が明らかになりました。
そして、このiPS細胞を観察した結果、αシヌクレインというという異常タンパク質が蓄積されていることが判明しました。従来の仮説及び家族性パーキンソン病患者の死後脳の観察・実証においても、同様に、αシヌクレインが確認されていましたので、上記のiPS細胞の観察結果は、家族性パーキンソン病患者から作製したiPS細胞由来の神経細胞を用いる事で、同一の患者の脳内で起きている現象を忠実に再現することを世界で初めて証明したことになります。
詳しくはこちら。
![]()
高橋教授は、上記の基礎研究の結果を踏まえて、iPS細胞から作った神経細胞をパーキンソン病患者に移植する臨床研究を、2015年度内に実施を目指すことを明らかにしました。安全性を高めた手法の計画を来年2014年度にも国に申請する予定です。
高橋教授による研究計画の申請が、予定通り平成26年度中に行われれば、文部科学省のiPS細胞研究ロードマップ通りの進捗となります。
「iPS細胞研究ロードマップ平成21年6月文部科学省」より抜粋
しかし、臨床研究開始後の詳細なスケジュールは明らかにされておらず、実用化に至るまでは慎重に研究の動向を見守る必要がありそうです。
(参考資料)
柏原健一 武田篤 前田哲也 著 : みんなで学ぶパーキンソン病 南江堂 2013/5
文部科学省 iPS細胞等研究ネットワーク ホームページ http://www.ips-network.mext.go.jp/
パーキンソン.jp http://www.parkinson.jp/index.html