
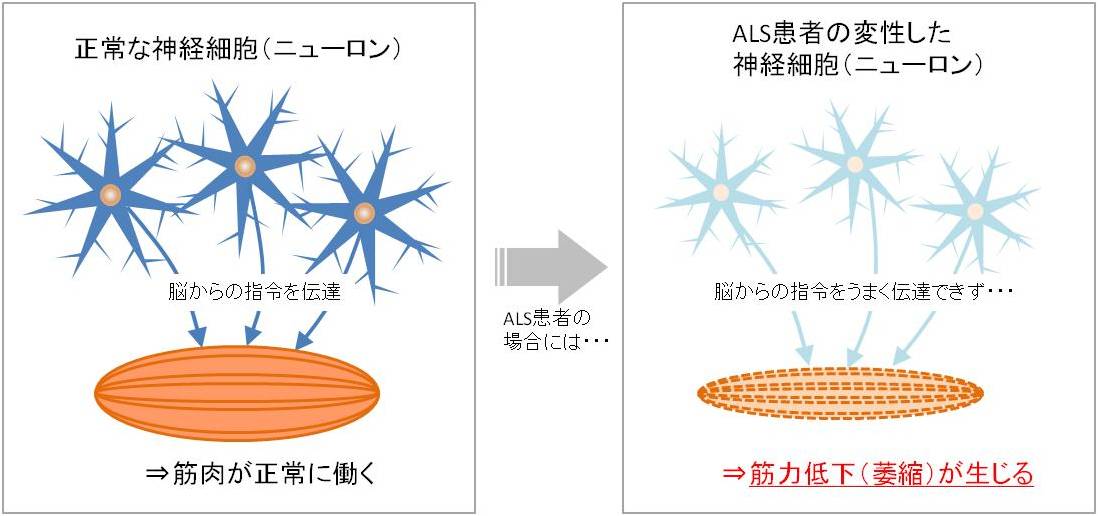
脳からの指令を筋肉へ伝達する運動ニューロンの変性により、全身の筋肉に運動障害(マヒ)が起こり、通常は人工呼吸器を装着しなければ3~5年以内に死亡すると言われています。
身体の神経は脊髄から枝分かれし、運動ニューロン(長いものでは1メートルにもなり、軸索と呼ばれる細長い細胞をミエリン鞘(多くのニューロンの軸索の周りに存在する絶縁性のリン脂質の層)が保護)と呼ばれている中枢神経細胞を含み、この細胞が脳からの指令を筋肉へ伝達します。ALSでは、この運動ニューロンが変性し死滅することで、食物を食べたり、話したり、歩行したりすることを可能にする筋肉への情報伝達ができなくなり、筋力低下(萎縮)が生じ、運動をコントロールできなくなります。
日本では、およそ7000人がALSに罹患しています。中高年以降は発症率が特に高くなっています。全症例のうち、遺伝的な要因に基づくもの(「家族性」と呼ばれる)が10%程度で、大半は「孤発性(非遺伝型)」で、その原因は不明です。
■ ALS(筋萎縮性側索硬化症)の主な治療法とは?
残念ながら、まだ有効な治療法は確立されていません。
もっとも、症状の進行を遅らせる作用のある薬(リルゾール)の効果は確認されており、人口呼吸器装着やリハビリテーション等の対症療法も存在します。
■ 再生医療/iPS細胞によるALS(筋萎縮性側索硬化症)の治療
運動ニューロン等の細胞移植
ES細胞やiPS細胞をはじめとする幹細胞を使う方法としてはいくつか考えられています。
まず、脊髄に幹細胞由来運動ニューロンを移植して、その機能を補完するという方法があります。
その他には、運動ニューロンを保護する機能を有する幹細胞由来グリア細胞(神経系を構成する神経細胞ではない細胞の総称)を移植する方法などです。(ラットを用いた最近の研究で、グリア細胞を移植することで運動ニューロンの機能が回復し、疾病の進行を遅らせることができることが示されました。)
現在の実験では、脊髄のどこに細胞を移植すれば、離れた位置にある筋肉に最も大きな効果をもたらすことができるかを明らかにしようとしています。
疾病の解明と創薬研究
iPS細胞を活用してALS患者の細胞を運動ニューロンに分化させ、実験室内で、患者自身の細胞で疾病の経過を研究し、何が運動ニューロン等の細胞の変性の引き金になっているのかを調べることができるようになっています。また、これは同時に、どの薬剤・化合物が治療に有効かについて、iPS細胞を活用して調べることも可能になったということを示しています。
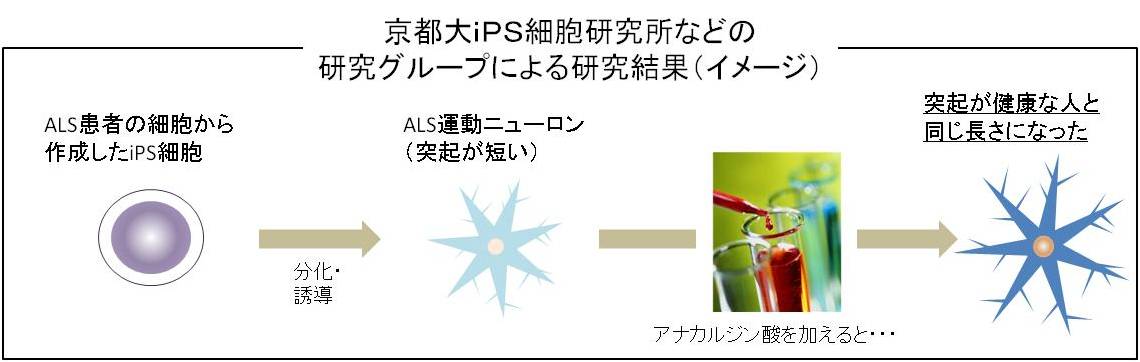
この点について、2012年8月に、京都大iPS細胞研究所などの研究グループグループの井上治久准教授らは、症状を抑える治療薬の候補となる化合物を発見したと報告しています。
まず、井上准教授らは、50歳代のALS患者の皮膚からiPS細胞を作製し、ALS運動ニューロンに分化・誘導し、この中には大量のTDP-43(脳からの指令を筋肉に伝える運動神経の細胞内で遺伝子の働きの強弱を調節する役割を持つたんぱく質)が大量に変性・蓄積され、その影響で、運動ニューロンの突起部分が健康な人より短くなっていたことを突き止めました。
そして、アナカルジン酸という化合物を加えることで、変性したTDP-43が減少し、運動ニューロンの突起の長さが2倍になり、健康な人のものと同じ長さになったことを報告しています。この研究結果は、治療薬開発への第一歩といえます。
これまでは患者から運動ニューロンを取り出すことができなかったために、その病態をそのまま反映するモデルを作ることが難しく、有効な治療薬開発は進んでいませんでしたが、上記のようなiPS細胞の活用により、今後の新薬開発を大きく加速することが期待されます。
(参考資料)
難病情報センター:http://www.nanbyou.or.jp/
文部科学省 iPS細胞等研究ネットワーク ホームページ http://www.ips-network.mext.go.jp/
